2023年10月3日,山东中医药大学中医药创新研究院李霞教授课题组联合上海交通大学医学院邹强研究员课题组等在国际期刊《临床研究杂志》(The Journal of Clinical Investigation)(中科院一区,五年影响因子:16.7)发表题为“USP47抑制m6A依赖性c-Myc翻译以维持调节性T细胞代谢和功能稳态”(USP47 inhibits m6A-dependent c-Myc translation to maintain regulatory T cell metabolic and functional homeostasis)的研究论文。本项研究发现,调节性T细胞(Treg)可通过USP47基因表达抑制翻译起始复合物的组装以限制c-Myc翻译效率和Treg细胞中相关糖酵解代谢,揭示了m6A依赖性代谢重编程在建立免疫耐受中协调Treg细胞稳态和功能的重要性。
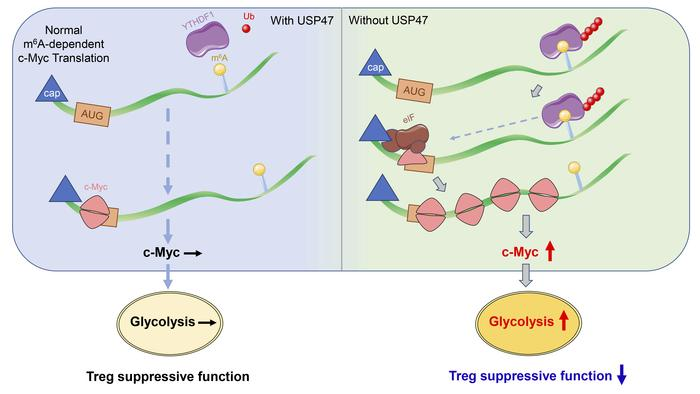
机理模式图(图源自Journal of Clinical Investigation )
Treg可通过免疫抑制作用预防自身免疫性炎症,并在肿瘤微环境中发挥重要的调控功能。Treg细胞的功能和命运决定受到细胞代谢途径的严格调节。研究表明Treg细胞正常功能发挥需要糖酵解活化,但过量和持续的糖酵解会导致Treg细胞不稳定。然而,Treg细胞糖代谢网络的精细调控尚不清楚。围绕上述关键科学问题,为了确定肿瘤微环境中调节Treg细胞功能的关键因子,研究人员分析了癌症基因组图谱(TCGA)结肠癌(COAD)数据集中肿瘤浸润Treg细胞的基因表达谱,发现在COAD患者中Treg细胞特征和USP47表达之间存在显著正相关。进一步通过条件性敲除小鼠及肿瘤模型建立等手段,证实USP47缺失可破坏Treg细胞稳态和功能;同时,由USP47缺失引发的Treg功能下降一方面可导致炎症疾病的发展,另一方面可提高T细胞抗肿瘤免疫反应。机制上讲,USP47通过抑制YTHDF1泛素化,从而减弱YTHDF1与翻译起始复合体的结合,进而降低基于m6A的c-Myc翻译效率。更重要的是,临床表征相关的Treg细胞USP47基因下调触发了c-Myc蛋白的积累,进而加剧了高糖分解及Treg细胞的功能紊乱。
本项研究系统阐述USP47-YTHDF1-cMyc通过调控糖酵解过程维持Treg细胞稳态的关键作用机制,为自身免疫疾病和肿瘤免疫治疗提供了新的干预靶点和策略。上海交通大学医学院邹强研究员、上海交通大学附属瑞金医院肛肠外科赵任教授、山东中医药大学中医药创新研究院李霞教授和河北大学附属医院倪志宇教授为本论文共同通讯作者,深圳先进技术研究院王爱婷和上海交通大学附属瑞金医院黄海燕博士为本论文第一作者。
文章链接:https://www.jci.org/articles/view/169365