
线粒体是真核细胞的动力源,调节细胞代谢和分化,而细胞间的线粒体转移已被证明能够影响受体细胞的存活。线粒体是否可以转移到干细胞,以及这种转移是否会改变干细胞的命运尚不清楚。
2022年12月11日,武汉大学张玉峰及季耀庭共同通讯在Advanced Science在线发表题为“Mitochondrial Transfer Regulates Cell Fate Through Metabolic Remodeling in Osteoporosis”的研究论文,揭示了骨髓环境中细胞串扰的一种新模式,巨噬细胞通过将其线粒体转移到MSCs中来调节骨代谢。同时提示线粒体转移可能是一种通过使免疫细胞调节其局部组织环境来调节机体稳态的新途径。靶向线粒体转移预防骨丢失为治疗和预防骨质疏松提供了新的途径,为改善代谢相关疾病提供了新的策略。

图1 巨噬细胞和间充质干细胞在骨环境中细胞线粒体转移影响骨代谢的作用方式(摘自Advanced Science)
M1型巨噬细胞向MSC的线粒体转移增加会引发活性氧爆发,从而导致代谢重塑。结果表明,骨髓MSC代谢异常是由琥珀酸异常积累引起的,琥珀酸积累异常是成骨分化异常的关键因素。上述结果表明,线粒体从巨噬细胞转移到MSC允许代谢串扰来调节骨稳态。该机制确定了治疗骨质疏松症的潜在靶点。
骨髓中各种细胞类型的协调活动对于维持体内平衡至关重要。骨稳态主要由破骨细胞的骨吸收和成骨细胞的骨形成之间的平衡决定,与整体代谢密切相关。骨质疏松症是一种全身性代谢性疾病,其特征是骨稳态失衡、骨量减少和微结构改变。先前的研究表明,免疫细胞(如巨噬细胞)对于维持骨稳态至关重要,并参与骨质疏松症的发展。巨噬细胞是响应环境刺激而转化为促炎(M1)或抗炎(M2)状态的异质细胞群,这些细胞通过分泌相关因子来调节骨稳态。巨噬细胞通过骨抑素 (OS)-M和骨形态发生蛋白 (BMP)-2分泌促进间充质干细胞(MSC)的成骨分化。白细胞介素 (IL)-6和肿瘤坏死因子 (TNF)-α由促炎M1型巨噬细胞分泌并抑制成骨功能。目前巨噬细胞与MSC之间信号传导的研究主要集中在巨噬细胞如何通过旁分泌信号传导调节间充质干细胞活性。

图2验证线粒体从巨噬细胞转移到MSCs

图3骨质疏松时巨噬细胞线粒体功能的改变
为了研究骨质疏松症中巨噬细胞的代谢特征,作者分析比较了Sham和OVX小鼠的巨噬细胞转录组,并用所分析基因的主成分分析(PCA)和层次聚类(HC)探索了在骨质疏松条件下是否诱导特定基因集的表达,以确定阶段特异性代谢谱。结果发现OVX小鼠的富集主要包括免疫效应过程的调节、氧化应激反应、线粒体组织和线粒体ATP合成与电子转运、碳水化合物转运和葡萄糖跨膜转运耦合。代谢相关通路,如HIF-1和PI3K-Akt信号转导也在骨质疏松中富集。此外,与假小鼠相比,来自小鼠的BMMS表现出特定线粒体过程的富集,包括复合物I、复合物III、活性氧、谷胱甘肽代谢、碳水化合物代谢和三羧酸(TCA)循环。

图4骨质疏松时巨噬细胞线粒体功能的改变
有巨噬细胞和间充质干细胞存在的骨髓是一个自由分散的环境。因此,有必要研究巨噬细胞能否将线粒体转移到MSC中来调节MSC的命运。该团队旨在研究在骨质疏松条件下经历线粒体特异性能量应激释放氧化损伤的线粒体的巨噬细胞,以及线粒体递送对活性氧(ROS)产生和MSC成骨功能的影响。结果表明,循环琥珀酸诱导ROS水平升高和缺氧诱导因子-1α(Hif-1α),促进促炎基因表达增加,进而影响MSC的成骨分化

图5巨噬细胞及其衍生线粒体对MSCs代谢状态的影响
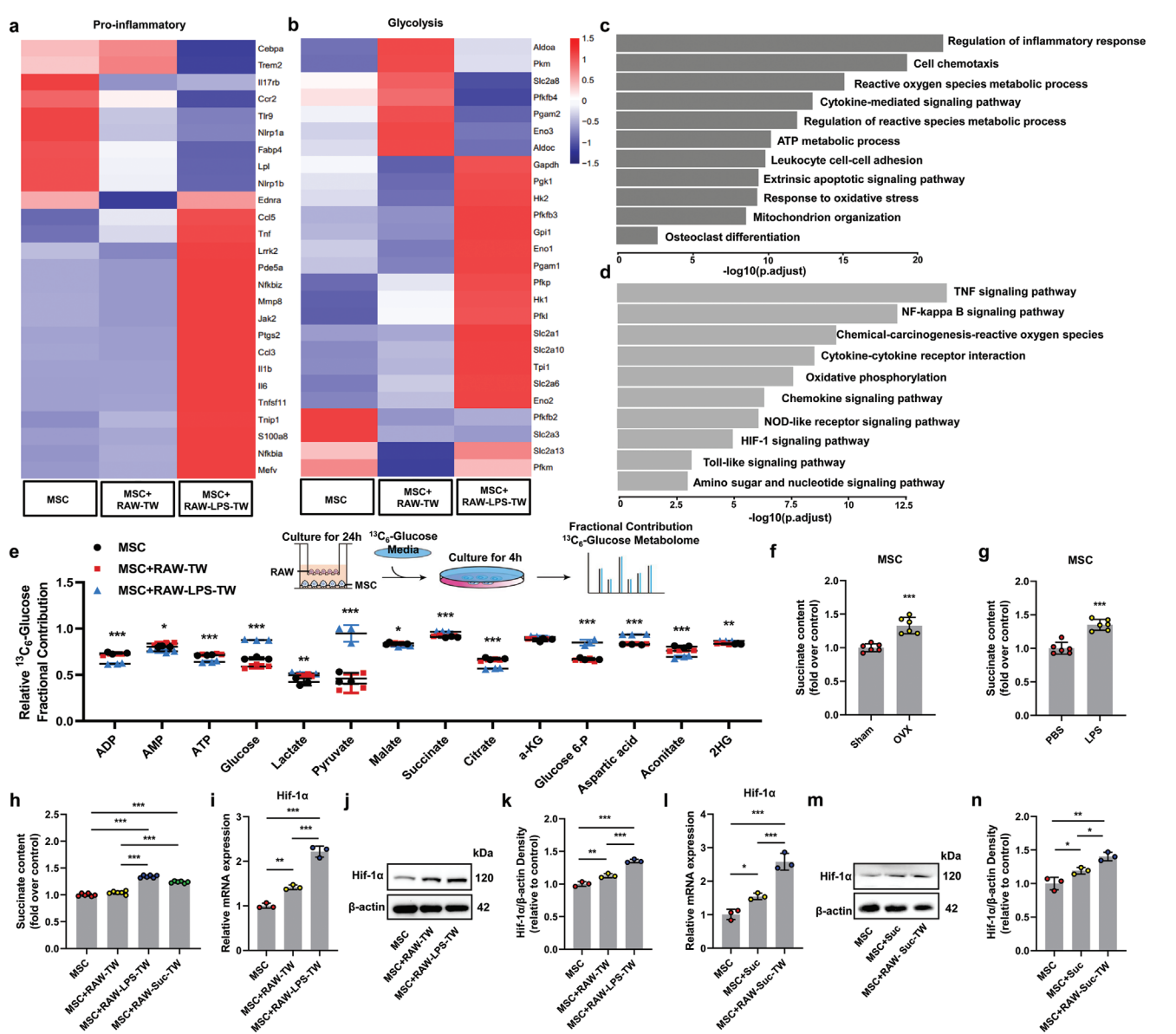
图6线粒体转移引起MSCs琥珀酸异常积聚
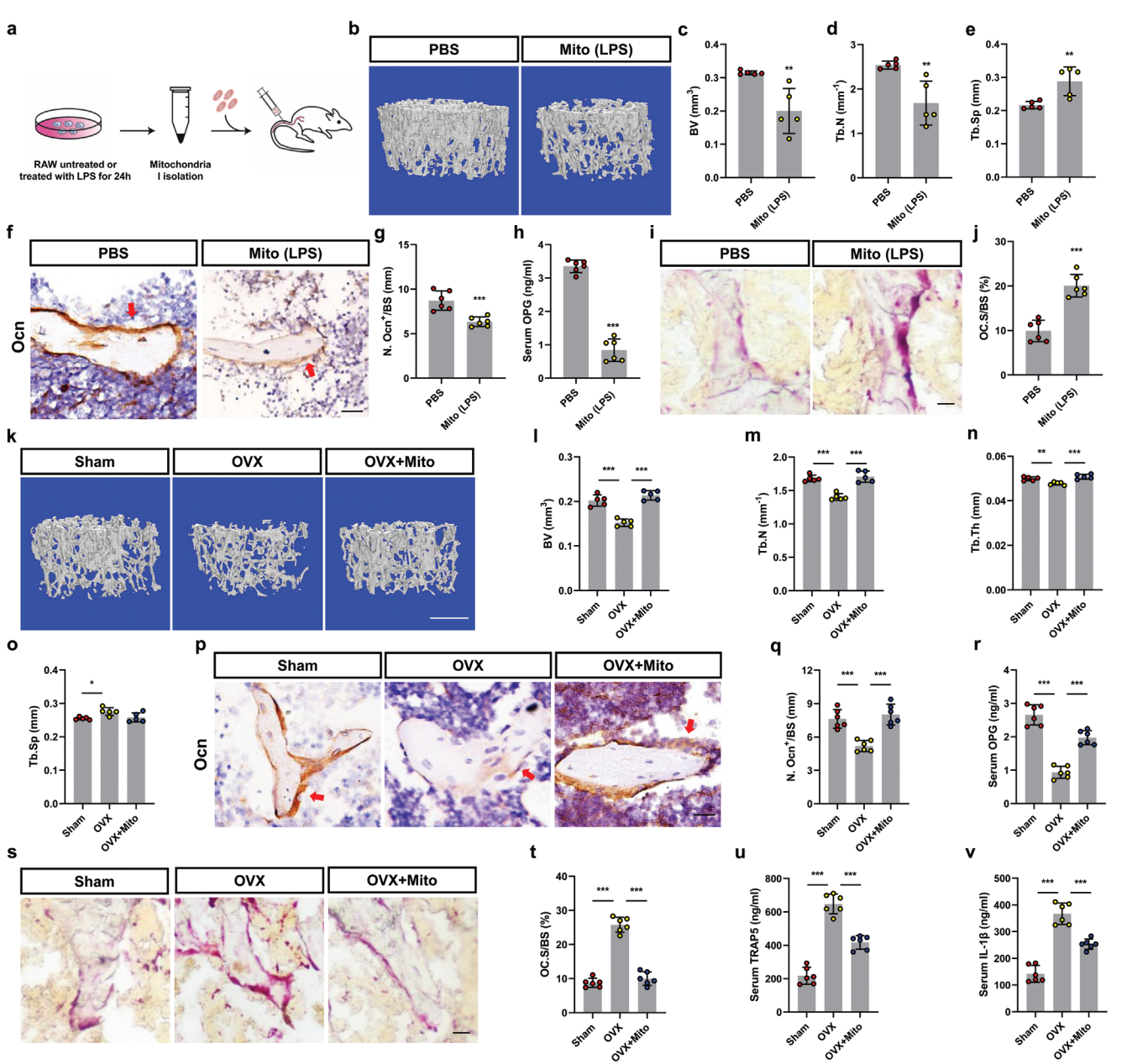
图7线粒体转移维持体内骨健康
骨髓微环境中的细胞间线粒体转移代表了一种未被充分认识的细胞通讯机制,该机制对骨代谢具有多种调节作用,并为骨质疏松症的预防和治疗提供了新思路。