广州中医药大学华南针灸研究中心许能贵教授团队在国际权威期刊Nature Communications(《自然通讯》)在线发表研究论文,揭示了针刺治疗中风后吞咽障碍的重要机制,首次证实电针刺激廉泉穴能有效治疗中风后的吞咽障碍。临床中,对位于舌骨上方凹陷处廉泉穴的电刺激常被用来治疗吞咽障碍。然而,此前这种通过对外周穴位的刺激治疗吞咽障碍的机制并不明晰。
该研究表明了CV23穴位的电刺激作为一种外周刺激策略,可以通过PBN激活运动皮层对NTS的输入,从而改善PSD模型小鼠的吞咽功能。该研究首次解析了M1-PBN-NTS神经环路在电针廉泉穴调控吞咽功能中的重要作用,阐明了电针刺激廉泉穴治疗吞咽障碍现代神经生物学机制。该论文是针对中医基本理论的现代研究,研究的创新成效将进一步提升中医针灸在医学研究领域的国际影响力。

1.M1 L5神经元的光遗传学激活控制下颌舌骨活性
团队首先利用跨多突触的病毒神经示踪技术在初级运动皮层(M1)中发现了一簇兴奋性神经元,并通过化学遗传技术验证了调控这类兴奋性神经元可以调节参与吞咽行为的重要肌肉下颌舌骨肌的活动。将经突触逆行伪狂犬病病毒注射到下颌舌骨中,并在M1 L5中观察到EGPF阳性神经元。将AAV2/9-CaMKIIα-ChR2-mCherry病毒注射到M1 L5中,并在下颌舌骨中记录EMG反应以评估下颌舌骨的活性,通过蓝光刺激诱导的膜电位去极化和动作电位放电的体外切片电生理记录确定了病毒的功能,这些结果表明,M1 L5神经元通过调节下颌舌骨活性来调节吞咽功能。(图1)
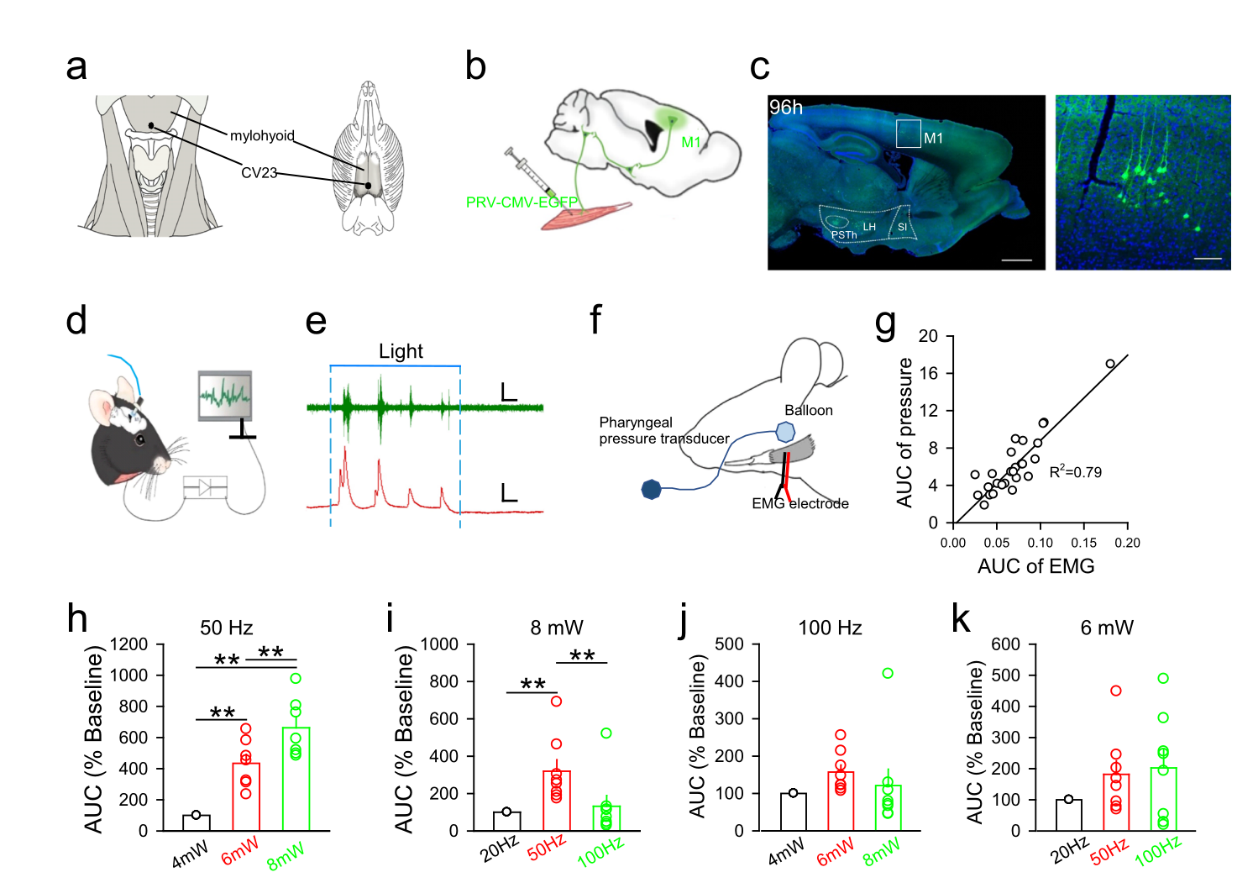
图1M1 L5神经元的光遗传学激活控制了下颌舌骨的活性
2.PSD病理可通过M1中的光致变色缺血模拟,并通过EA-CV23减弱
为了研究M1损伤是否可诱导吞咽困难,团队首先通过腹膜内注射孟加拉玫瑰(RB)和M1区域的激光照射在小鼠M1中诱导局灶性缺血。与对侧区域相比,缺血M1和前额叶皮层(PFC)的血流量减少,与非缺血和PFC缺血组的小鼠相比,M1缺血组的鼠体表现出吞咽困难,如水输送诱导的肌脂蛋白肌电图反应的AUC受损以及M1缺血小鼠的耗水量减少,该结果表明M1的局灶性缺血可诱导小鼠下颌舌骨的EMG反应受损,并减少耗水量。接下来,为了确定EA-CV23是否减轻了PSD模型小鼠的吞咽困难,在EA-CV22后24小时进行了下颌舌骨的EMG记录和耗水量测试。除AUC外,EA-CV23后PSD小鼠的EMG反应的所有振幅、频率和发作潜伏期均显著增加。总之,这些结果表明EACV23改善了由M1局部缺血引起的吞咽功能障碍。(图2)

图2 EA-CV23改善了M1单侧光致变色缺血诱导的吞咽困难小鼠模型的吞咽功能
3.EA-CV23对PSD的影响取决于对侧M1 L5兴奋性神经元的活动
研究团队通过免疫荧光染色检测M1中CaMKIIα(兴奋性神经元的标记)或GAD67(抑制性神经元的标志)阳性神经元中c-Fos(细胞激活的标记)的表达,结果显示,在PSD模型小鼠中,M1 L5中的兴奋性神经元被EA-CV23激活。然后,为了评估EA-CV23在体内诱导的对侧M1 L5兴奋性神经元的激活,将AAV2/9-CaMKIIα-GCaMP6s病毒作为钙(Ca2+)指示剂注射到M1 L5中。21天后,双光子激光显微镜成像显示,在PSD模型小鼠中,EA-CV23后,M1 L5中的个体体细胞Ca2+瞬态增加。体外和体内结果表明,EACV23激活了PSD模型小鼠对侧M1 L5兴奋性神经元。总体而言,这些结果支持对侧M1 L5兴奋性神经元对PSD模型小鼠中EACV23引起的吞咽功能改善的重要贡献。(图3)
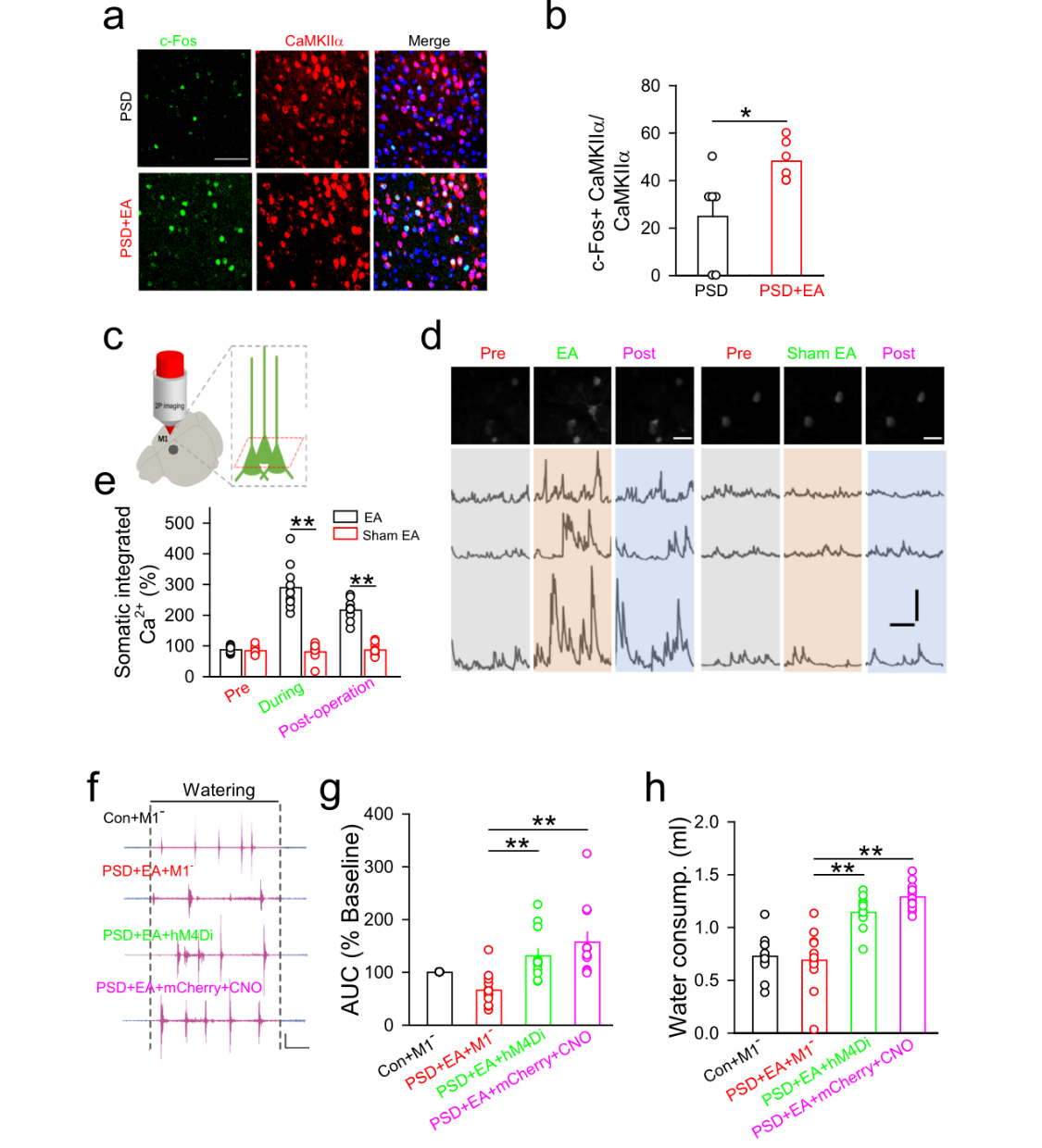
图3 EA-CV23对缺血小鼠的治疗作用需要对侧半球M1 L5兴奋性神经元的活性
4.PBN神经元的活性是EA-CV23对PSD模型小鼠吞咽功能障碍影响所必需的,并受M1激活的调节。
研究团队观察到在正常小鼠中EA-CV22增加了PBN中c-Fos的表达,以及M1、NTS、室旁下丘脑(PVH)、下丘脑和丘脑。在EA-CV23后PSD模型小鼠的PBN中也检测到c-Fos表达的增加,这些结果表明,在生理和病理条件下,EA-CV23都可以激活PBN中的神经元。
团队发现在抑制PBN神经元后,EA-CV23介导的由水输送诱导的EMG反应改善被消除,并且在两种生理条件下,对这些神经元的抑制也降低了下颌舌骨的EMG响应和PSD。总之,这些结果阐明了PBN神经元在吞咽功能中的关键作用以及EA-CV23治疗PSD的能力。(图4)
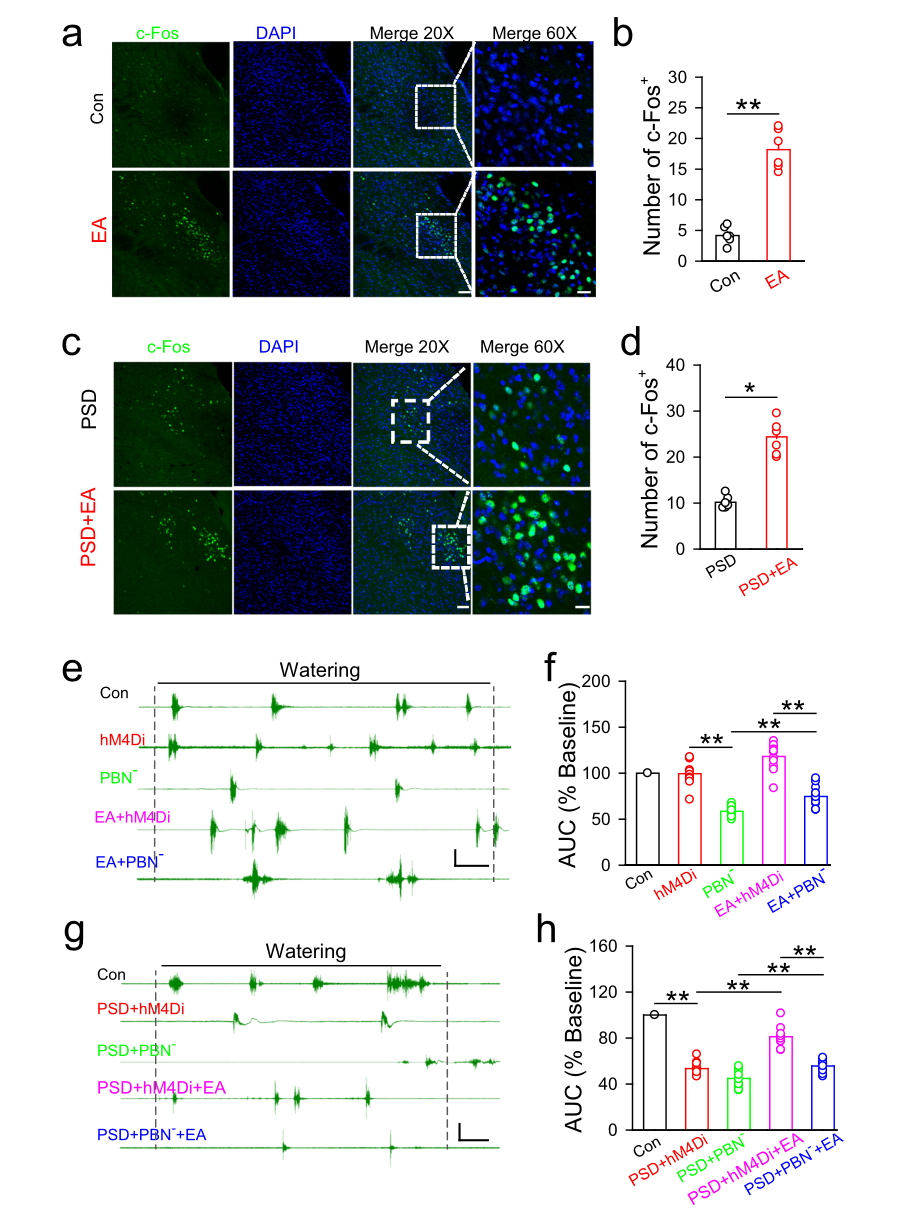
图4 PBN中的神经元参与了吞咽功能的调节以及EA-CV23对PSD的治疗作用
5.M1-PBN-NTS神经回路参与吞咽功能的调节,并介导EACV23对PSD的保护作用
接下来,团队探讨了NTS是否与M1-PBN神经回路相连,从而参与吞咽过程。NTS在吞咽功能中的作用首先通过对NTS神经元的抑制削弱了由水输送诱导的下颌舌骨活性来揭示,并减弱了EACV23诱导的PSD模型小鼠NTS中c-Fos表达的增加。通过顺行突触性AAV追踪验证了PBN和NTS之间单突触连接的存在,在NTS中观察到EGFP标记的神经元,表明NTS可能受到PBN的调节。然后,为了探索NTS中的神经元活性是否受到M1和PBN的调节,在M1神经元的光遗传学激活和PBN神经元的抑制之后,使用体内多通道记录来记录神经元尖峰。因此,这些结果表明,PBN和NTS共同调节吞咽功能,这些调节作用参与了EA-CV23对PSD的治疗作用。(图5)
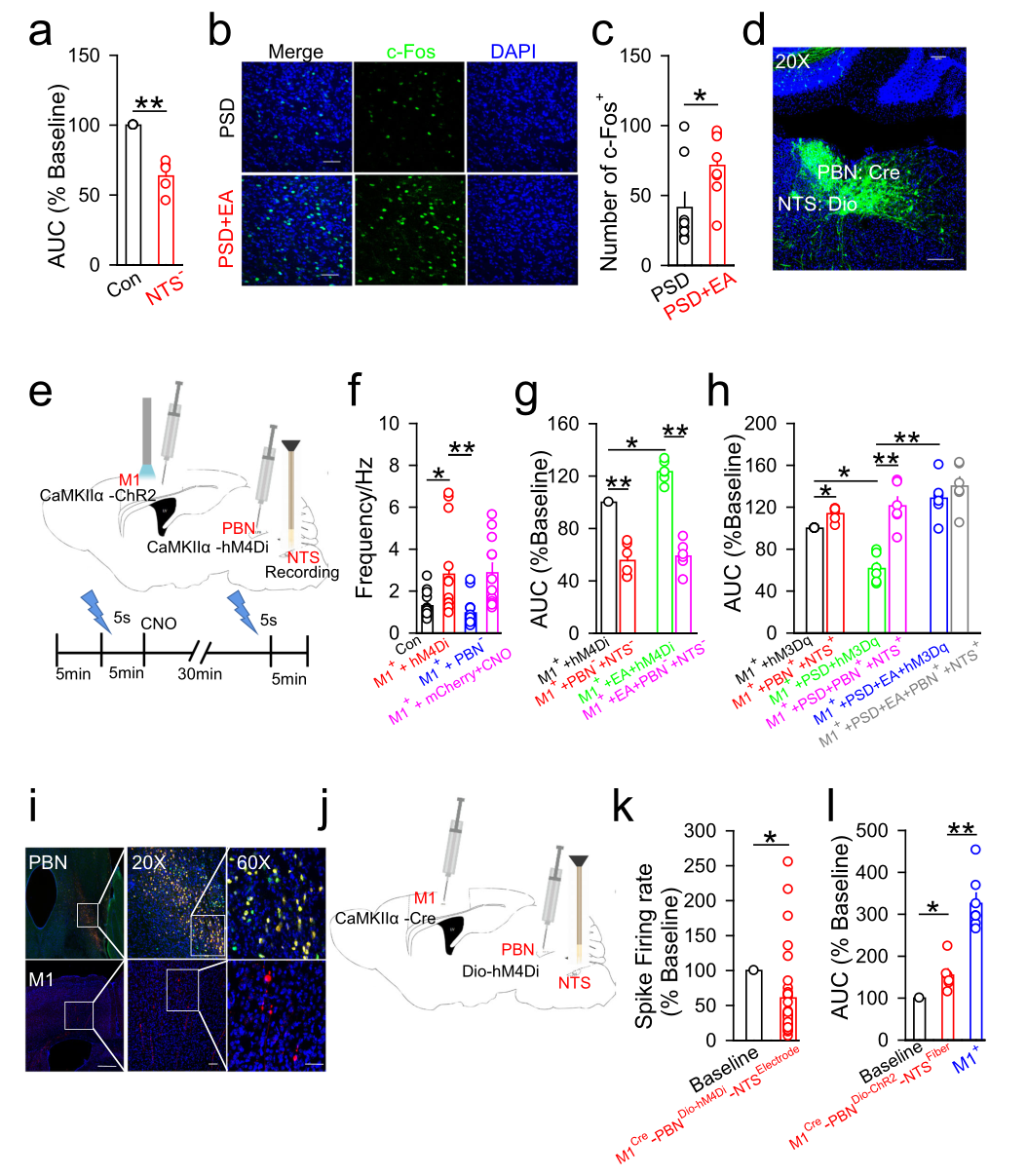
图5 M1-PBN神经回路参与了吞咽功能的调节
总结:
团队假设间接的M1-PBN-NTS神经回路,其中PBN中的一簇神经元可能由M1支配,而另一簇神经元投射到NTS,它们的信号在PBN内传递,也可能与吞咽功能有关。总之,直接和间接的M1-PBN-NTS神经回路都可以参与吞咽功能,并介导EA-CV23对PSD的治疗作用。(图6)
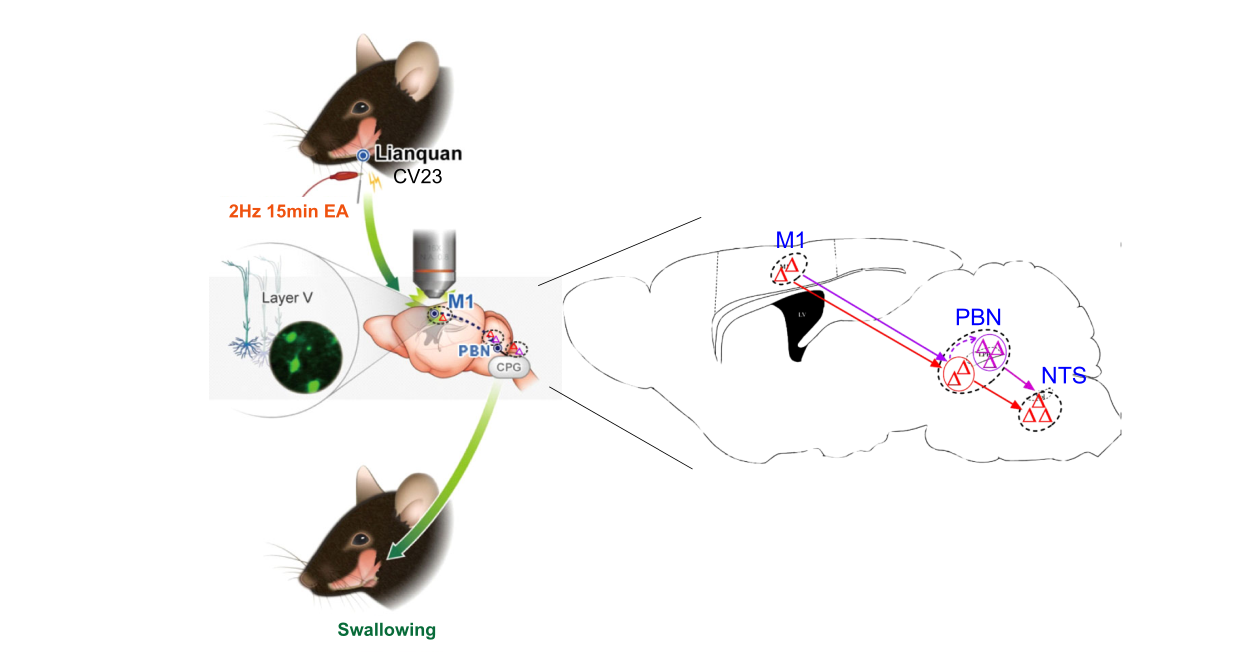
图6 EA-CV23对PSD治疗作用的机制示意图