阿尔茨海默病(Alzheimer’s disease,AD)是世界上最常见的神经退行性疾病,在我们的老龄化人口中越来越普遍,科学家们已经寻求能够减缓疾病进展的治疗干预措施。尽管认知能力下降和脑萎缩与AD中tau原纤维的形成有关,但找到进入大脑、进入容纳tau原纤的神经元并分解原纤维的有效疗法仍然是一个挑战。

加州大学洛杉矶分校的研究人员发现了绿茶中的一种分子是如何分解tau蛋白缠结的,并确定了其他也可以解开tau蛋白缠结的分子,它们可能是比绿茶分子更好的候选药物。由美国国家衰老研究所(NIA)资助的研究结果于2022年9月发表在《自然-通讯》(Nature Communications)杂志上,表明这种方法可能有一天会成为治疗AD的有效策略。
在AD等神经退化性疾病中,tau会异常地凝聚成纤维结,即“tau结”。这些“tau结”阻碍了神经元的正常工作,导致神经元的死亡。因此,将“tau结”分解成单体就成为治疗AD的思路之一。
大量研究表明,绿茶中的表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)可以解开这些tau纤维。然而,由于它不能轻易穿透血脑屏障,且会与tau蛋白以外的许多蛋白质结合,特异性差。所以,研究人员希望找到能够复制EGCG效果但具有更好药物特性的分子来治疗AD。
在这项研究中,研究人员从阿尔茨海默病患者捐献的死后脑组织中分离出tau蛋白缠结。用EGCG和速冻处理缠结。EGCG和tau纤维复合物的图像是用一种称为低温电子显微镜的技术捕获的。
这些EGCG-tau纤维图像有助于揭示EGCG是如何附着和分解tau纤维的。根据该团队的模型,EGCG与每一层纤维的裂缝或开口结合,使层不稳定,并慢慢地将纤维撬开。
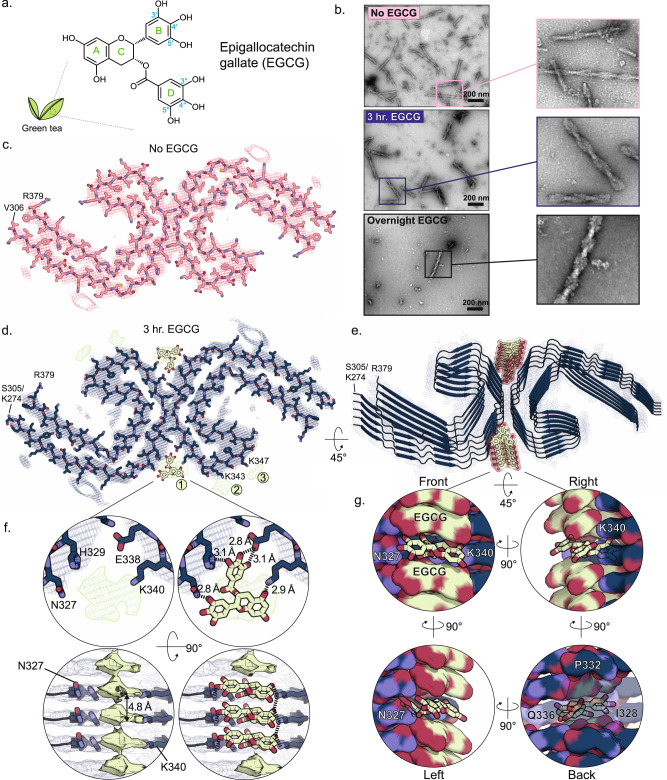
Fig. 1 | CryoEM structure of AD-tau PHF in complex with EGCG
通过计算机模拟,研究人员确定了其他分子可能以与EGCG类似的方式工作,但可能更容易进入大脑。他们在tau蛋白缠结形成的细胞模型中测试了这些其他分子,另外还测试了从阿尔茨海默病患者死后捐赠的大脑样本中分离出来的tau蛋白缠结。在这两种情况下,有几个分子解开了缠结的tau纤维。尽管研究人员警告说还需要做更多的工作,但实验表明,某些分子也阻止了未缠结的tau蛋白扩散并形成新的缠结。
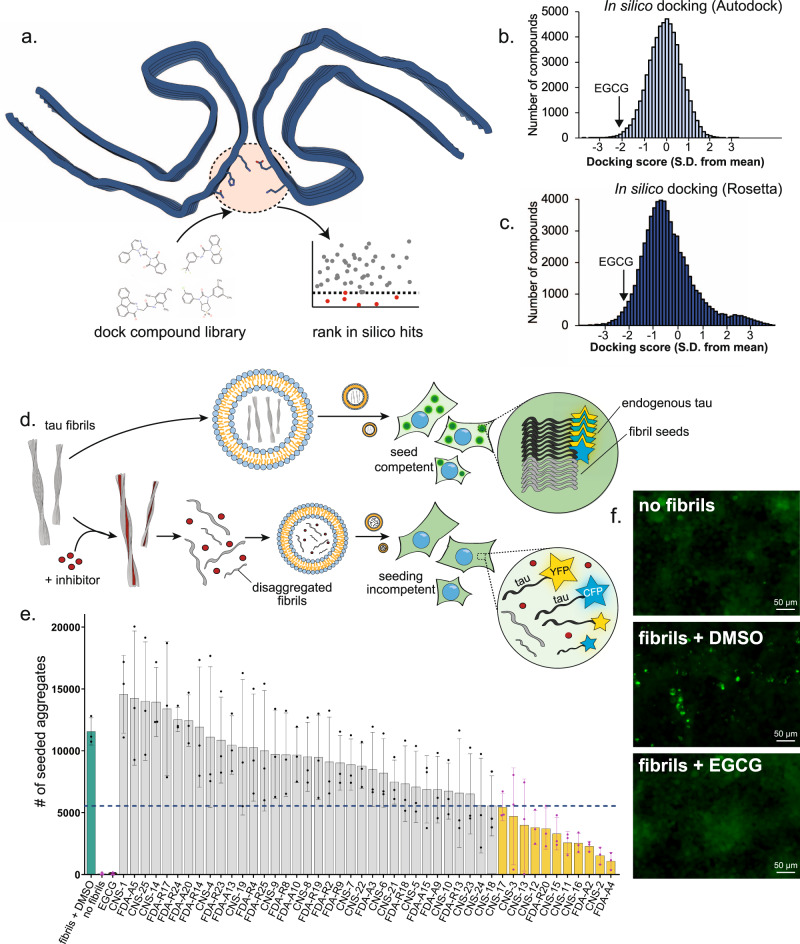
Fig. 2. In silico and in vitro screening of tau disaggregants using EGCG pharmacophore.
总的来说,研究结果表明,这些新发现的可以穿透大脑并分解tau蛋白缠结的分子可能是治疗阿尔茨海默病的一种有前途的策略。未来对这些分子的研究可能有助于更多地揭示它们的治疗潜力。