
背景:1.胰腺癌是一种恶性肿瘤,发病隐匿,进展迅速,使大多数胰腺癌患者无法接受手术,因此迫切需要了解胰腺癌的生物学机制和分子机制,为胰腺癌的综合治疗开发新的治疗策略。
2.铁死亡是一种铁依赖性的新的细胞死亡形式,其特征是脂质过氧化。其途径中的多种关键分子,如细胞内铁水平、GPX4、SLC7A11、GSH、ROS、HSPA5、H2O2,可用于靶向铁死亡治疗。最近,铁死亡在胰腺癌中的作用逐渐被报道。研究铁死亡的调控机制可能为胰腺癌的治疗提供潜在的突破。
3.硫链丝菌素(Thiostrepton, TST)是一种蛋白质翻译抑制剂,有报道称TST可以抑制FOXM1和多种肿瘤的恶性行为,包括结直肠癌、乳腺癌、肺癌、急性淋巴细胞白血病、卵巢癌,甚至胰腺癌。然而,它是如何影响胰腺癌的,其潜在机制尚不清楚。
4.信号换能器和转录激活因子3 (STAT3)在细胞刺激下介导多种基因的表达,在细胞生长和凋亡等许多细胞过程中发挥关键作用。许多研究证实了STAT3以各种形式调节铁死亡,但其在胰腺癌中的作用尚未报道。

原理机制:SLC7A11是一种跨膜蛋白,介导胱氨酸/谷氨酸反转运蛋白活性,调节GSH合成影响铁死亡,是经典的铁死亡通路。在胰腺癌细胞中,硫链丝菌素(TST)不通过调节SLC7A11的表达诱导铁死亡,而是通过抑制STAT3的表达,激活的STAT3结合到GPX4启动子区域,促进其转录,TST通过抑制STAT3的表达进一步下调GPX4的表达,促进脂质ROS产生导致脂质过氧化,诱导铁死亡。
研究结果:
一、硫链丝菌素降低胰腺癌细胞的生存能力和克隆发生
TST被称为硫肽,具有抗癌特性,其化学结构如图1A所示。CCK-8结果表明,TST以剂量依赖的方式显著降低Panc-1、MIAPaCa-2和BxPC-3三种胰腺癌细胞的生长,IC50分别为5.54、2.10和3.57μM(图1B)。FOXM1因子失调会造成异常的细胞增殖,从而引发癌症。Western blotting结果显示,TST显著降低FOXM1蛋白表达水平(图1C)。此外,TST也以时间依赖的方式阻止胰腺癌细胞的生长(图1D)。最后,集落形成实验发现TST显著抑制胰腺癌细胞的克隆发生(图1E, F)。所有这些结果都表明TST抑制胰腺癌细胞增殖。
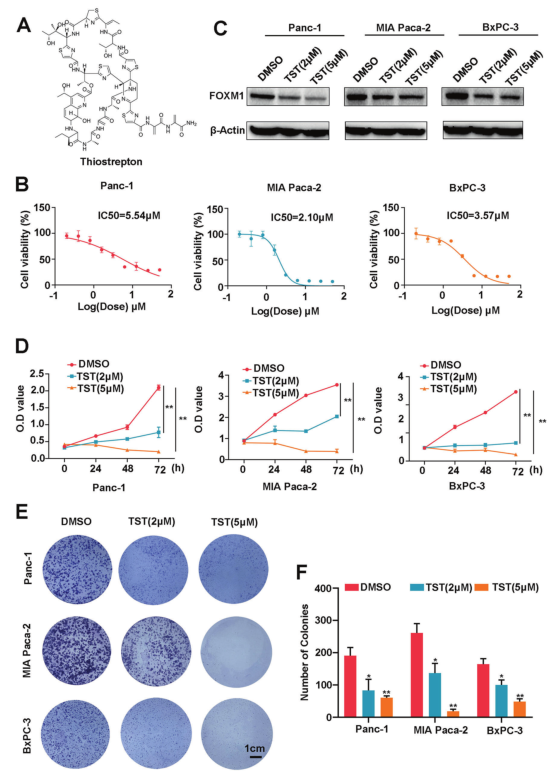
图1硫链丝菌素降低胰腺癌细胞的活力和克隆形成
二、硫链丝菌素促进胰腺癌细胞铁死亡
作者进一步探讨TST抑制胰腺癌细胞增殖的机制。利用透射电镜观察细胞的微观结构,发现处理后的细胞线粒体更小,线粒体膜密度更高,线粒体嵴减少(图2A)。因此,作者推测TST抑制细胞增殖的机制包括铁死亡。采用铁死亡诱导剂RSL3和抑制剂Fer-1作为实验干预,通过实验进一步证实这一假设。结果显示,RSL3和TST均能抑制Panc-1、MIAPaCa-2和BxPC-3细胞的增殖,而Fer-1则能显著挽救细胞增殖(图2B)。集落形成试验显示RSL3和TST显著抑制胰腺癌细胞的克隆发生,而Fer-1则相反(图2C, D)。使用氧化敏感荧光探针DCFH-DA测量细胞内ROS水平,结果表明RSL3和TST显著增加了ROS的产生,而Fer -1则相反(图2E)。此外,RSL3和TST组MDA水平显著升高,GSH-PX水平降低,而Fer -1组MDA水平则相反(图2F,G)。总的来说,这些数据支持了TST促进胰腺癌细胞铁死亡的假设。

图2硫链丝菌素促进胰腺癌细胞中的铁死亡。
三、硫链丝菌素激活STAT3-GPX4信号通路
作者探究由TST激活铁死亡的分子机制。SLC7A11和GPX4为铁死亡重要信号分子。western blotting实验显示,在TST干预后,SLC7A11蛋白水平没有明显变化,但GPX4蛋白水平明显下调,GPX4 mRNA水平也降低了(图3A,B)。先前的研究报道了GPX4受多种分子调控,包括STAT3。因此,作者假设TST通过调节STAT3来影响GPX4活性。western blotting实验显示TST显著抑制STAT3蛋白表达,STAT3磷酸化也相应降低(图3C)。免疫荧光染色结果显示,TST降低了细胞核和细胞质中STAT3和p-STAT3的表达(图3D, S2)。这些结果表明,TST可能通过STAT3调节GPX4蛋白和mRNA的表达。
接下来,作者探讨了STAT3如何调节GPX4的表达。作者通过在细胞中过表达STAT3,证实了STAT3上调了GPX4 mRNA和蛋白水平(图3E, F)。利用JASPAR网站预测GPX4启动子中的STAT3结合位点,揭示了GPX4启动子中的四个假定基(P1 - P4)(图3G, H)。因此,设计ChIP-qPCR来确认GPX4启动子区域中的STAT3结合位点,结果证实启动子区域的P2位点可能是STAT3的结合位点,而不是P1、P3或P4。(图3I)。最后,作者设计了含有P2 (WT2)位点和突变(MUT2)位点的荧光素酶报告基因质粒(图3J),并将其转染到293T细胞中。通过比较荧光值,发现STAT3过表达增加了WT2 GPX4启动子报告活性,但没有增加MUT2活性(图3K)。总的来说,这些数据表明TST通过降低STAT3的表达来改变GPX4的转录。
图3硫链丝菌素激活STAT3–GPX4 信号通路。
四、硫链丝菌素诱导的铁死亡依赖于STAT3-GPX4信号通路
作者在Panc-1、MIAPaCa-2和BxPC-3细胞中过表达STAT3,发现TST诱导的GPX4表达降低部分被STAT3过表达所挽救(图4A, B)。STAT3过表达也部分逆转了TST对胰腺癌细胞的杀伤作用(图4C)。同样,STAT3过表达部分挽救了TST诱导的胰腺癌细胞克隆生成的减少(图4D, E)。随后,作者进一步检测了铁死亡相关指标水平的变化。TST增加了ROS的表达,但这种作用被STAT3过表达抑制(图4F)。同时,STAT3过表达也逆转了TST引起的MDA和GSH-PX的异常水平(图4G, H)。综上所述,TST通过STAT3 - GPX4信号通路诱导铁死亡。

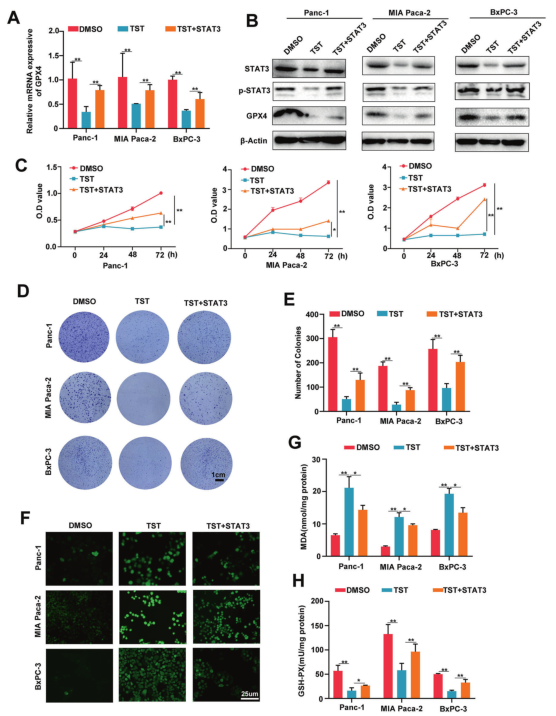
图4硫链丝菌素诱导的铁死亡依赖于STAT3-GPX4 信号通路。
五、硫链丝菌素在体内对胰腺癌有治疗作用
将转染不同结构的MIAPaCa-2细胞皮下注射到BALB/c裸鼠体内探究TST的体内治疗效果。小鼠一旦出现可触及的肿瘤就腹腔注射TST (17 mg/kg), TST + Fer-1 (5 mg/kg)或相同体积的生理盐水,每周三次,持续3周(图5A)。结果显示,TST抑制肿瘤生长,Fer-1逆转了这一效应(图5B-D)。此外,TST治疗组皮下肿瘤中FOXM1、STAT3、p-STAT3和GPX4的表达降低(图5E, F)。为了定量评估这些指标在异种移植肿瘤中的表达,作者对肿瘤切片进行了蛋白表达染色。结果显示,与对照组相比,TST组FOXM1、STAT3、p-STAT3、GPX4、Ki67染色较低(图5G, H)。
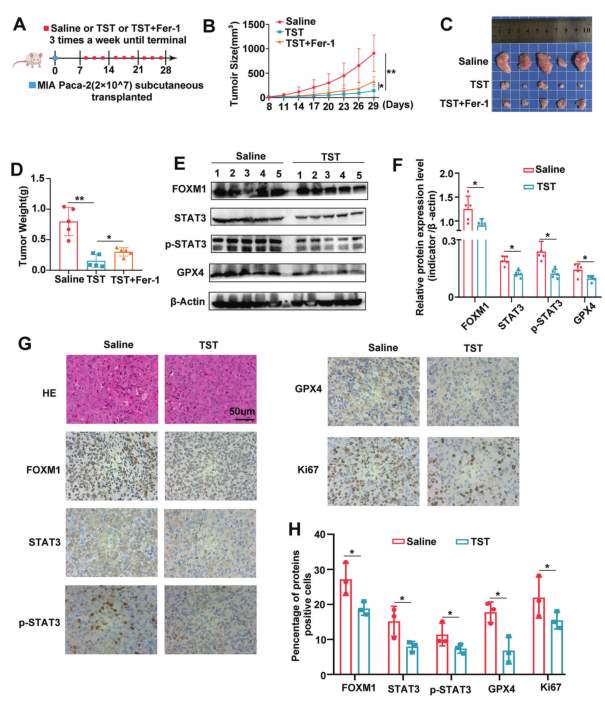
图5硫链丝菌素对体内治疗胰腺癌有作用
总结:
在本研究中,作者发现硫链丝菌素(TST)是一种有效的抗胰腺癌药物,可以通过抑制STAT3/GPX4信号通路诱导胰腺癌细胞铁死亡。机制上,STAT3可以结合到GPX4启动子区域促进转录,而TST通过抑制STAT3和p-STAT3的表达阻断GPX4的表达,促进脂质ROS介导的铁死亡。此外,体内实验表明TST可延缓皮下移植肿瘤的生长,具有良好的生物安全性。
原文链接:https://www.nature.com/articles/s41419-022-05082-3
指导教师:张振