Progressive Pulmonary Fibrosis Is Caused byElevated Mechanical Tension on Alveolar Stem Cells.Cell.2020 Jan 9;180(1):107-121.e17.
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(19)31284-X?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS009286741931284X%3Fshowall%3Dtrue
研究背景
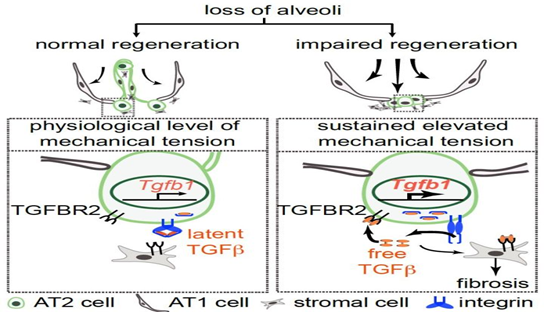
纤维化结缔组织的增厚和瘢痕形成的特征是成纤维细胞过度增殖和细胞外基质(ECM)成分的积累。这种疾病常见于许多器官,导致组织结构紊乱,导致器官功能严重受损。最常见的肺纤维化类型为特发性肺纤维化(IPF),这种疾病开始于肺周围,然后向肺中心发展,最终导致呼吸衰竭。IPF是一种致命疾病,诊断后的中位生存时间只有2-4年。有研究表明,失调的肺泡II型(AT2)细胞参与了IPF的外周向中心进展,但其机制和性质尚不清楚。作者研究发现发现肺泡II型(AT2)细胞中Cdc42蛋白的缺失会导致从肺周围到肺中心的进行性肺纤维化,证明机械张力升高激活了AT2细胞中的TGF-β信号环,从而驱动肺纤维化由肺周围向中心发展。作者发现细胞周期调控蛋白Cdc42对AT2细胞的分化和再生起着关键的调控作用,并建立了肺泡再生受损、机械张力和进行性肺纤维化之间的直接机制联系。(图1)
Result 1 AT2细胞中Cdc42蛋白缺失导致PNX处理或衰老小鼠AT2细胞分化受损
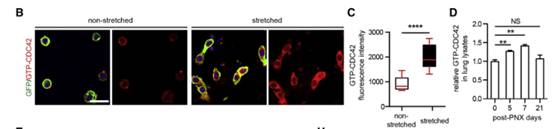
为了研究Cdc42在调节AT2细胞分化中的功能,作者首先分析了AT2细胞分化过程中Cdc42的活性。将小鼠AT2细胞培养在未拉伸或拉伸的硅膜上。第3天观察发现AT2细胞形状发生了显著变化。通过使用特异性识别鸟苷三磷酸(GTP)-CDC42的抗体进行免疫染色,发现GTP-CDC42在拉伸的AT2细胞中的表达水平显著增加(图B和C)。此外,肺叶切除术(PNX)后第5天和第7天肺叶裂解液中GTP-CDC42的水平显著升高(图D)。由此作者作出假设,激活Cdc42可能是AT2细胞分化为AT1细胞必需的条件。
为了验证这一假设,作者对Sftpc-CreER;Cdc42F/+;Rosa26-mTmG (对照)和Sftpc-CreER;Cdc42F/-;Rosa26-mTmG (Cdc42缺失)两组小鼠做左肺叶切除处理,在PNX操作21天后取肺进行免疫染色,发现在对照肺中观察到许多新分化的AT1细胞和新形成的肺泡(图F);而在Cdc42缺失的肺中则几乎没有AT2细胞分化为AT1细胞,也没有形成新的肺泡(图F),且外围区域中的平均肺泡大小显著增加。
在稳态条件下,AT2细胞缓慢分化为AT1细胞,形成新的肺泡。当小鼠2个月大时,作者剔除了AT2细胞中的Cdc42,小鼠12个月大时取肺观察(图H)。在对照肺中观察到许多新肺泡的形成(图I)。而在Cdc42缺失的肺中没有新肺泡形成且肺泡扩大(图I和J)。
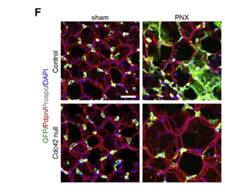
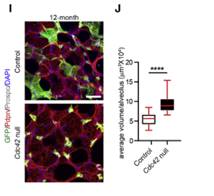
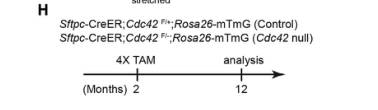
以上结果表明,无Cdc42的AT2细胞无法分化为AT1细胞,因此在肺泡稳态或PNX诱导的肺泡再生过程中都无法生成新的肺泡。
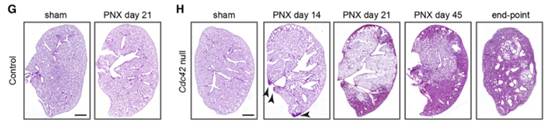
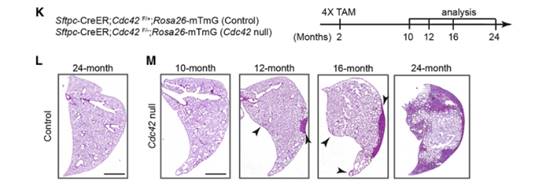
Result 2 AT2细胞中Cdc42蛋白缺失导致PNX处理或衰老的小鼠进行性肺纤维化
为了研究肺泡再生受损的长期效应,作者长时间跟踪观察PNX处理的Cdc42空白和对照小鼠的状态,发现Cdc42空白小鼠死亡时的最大肺活量(FVC)和肺顺应性均显著降低,而FVC降低和肺顺应性降低常在肺纤维化时发生。羟脯氨酸测定和H&E染色显示PNX处理的Cdc42空白小鼠的肺在死亡时出现严重纤维化(图H)。为了确定Cdc42空白小鼠开始出现肺纤维化的时间点,使用H&E染色分析了PNX处理后不同时间点的肺(图H)。在PNX处理后第14天,一些Cdc42空白肺的胸膜下区域显示出组织增厚的迹象;第21天,所有Cdc42空白肺的胸膜下区域显示出致密纤维化;第45天,大部分Cdc42空白肺的中心已出现致密纤维化。
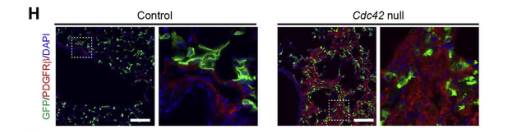
增殖性成纤维细胞的聚集是IPF的主要组织学特征,也被称为“成纤维细胞病灶”。而纤维化肺中的肌成纤维细胞表达高水平的β型血小板衍生生长因子受体(PDGFRβ),以此为指标,免疫染色结果表明Cdc42空白肺纤维化区域中的大多数基质细胞表达PDGFRβ,而对照肺仅气道和血管平滑肌细胞表达PDGFRβ(图H),这些PDGFRβ+细胞可以表达高水平的胶原蛋白I。
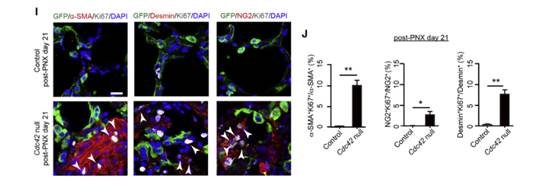
作者进一步利用α-平滑肌肌动蛋白(α-SMA)抗体、结蛋白(Desmin)抗体和NG2抗体对PDGFRβ+肌成纤维细胞的异质性进行了表征。结果发现Cdc42空白肺中并不是所有的PDGFRβ+细胞都表达α-SMA、Desmin和NG2,但是所有纤维化Cdc42空白肺中均含有增殖的α-SMA+、Desmin+和NG2+细胞,表明这些基质细胞促进肺纤维化的发展。(图I-J)
作者还分析了未经PNX处理的对照组和Cdc42空白小鼠的肺,发现10个月大的Cdc42空白小鼠没有明显的纤维化改变(图K-M),到12个月大时,Cdc42空白小鼠的肺胸膜下区域出现了明显的纤维化(图M),并且当Cdc42空白小鼠变老时,这种纤维化向肺中心发展(图M)。
Result 3单细胞转录组分析揭示了纤维化肺中特殊的AT2细胞群体
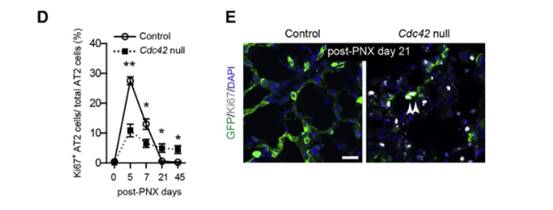
首先,作者通过透射电子显微镜(TEM)观察和免疫染色手段发现Cdc42空白肺在纤维化开始前,AT2细胞的极性和AT2细胞与邻近细胞的连接没有被破坏;对AT2细胞增殖情况进行观察分析,结果表明Cdc42空白肺在第21天有~4%的AT2细胞增殖,而对照肺中很少检测到AT2细胞增殖(图D和E),Cdc42空白肺中AT2细胞增殖有助于形成AT2细胞的聚集表型。为了确定这些异常AT2细胞在纤维化进程中的作用,作者使用单细胞RNA测序(scRNA-seq)来分析假手术和PNX处理的Cdc42空白和对照肺中AT2细胞的基因表达,结果表明Cdc42外显子2在Cdc42空白肺的AT2细胞中有效地被删除。(图A-C)
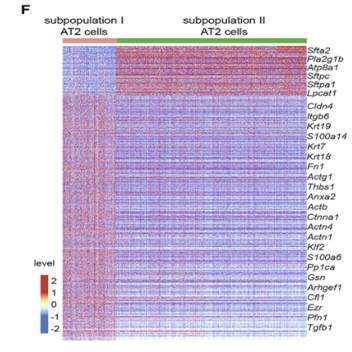
基于t分布随机邻域嵌入(t-SNE)的图显示,来自所有样本的AT2细胞聚集成两个亚群,亚群I和亚群II(图C)。假手术和PNX处理对照肺中的亚群I和亚群II分布没有差异(图D和E),但PNX处理的Cdc42空白肺中亚群I的数目到第21天时增加了10倍,这一差异表明亚群I型AT2细胞在Cdc42空白肺中富集。作者接下来进一步证明了亚群I AT2细胞与肺泡再生有关,是AT2细胞分化为AT1细胞过程中的中间细胞状态。
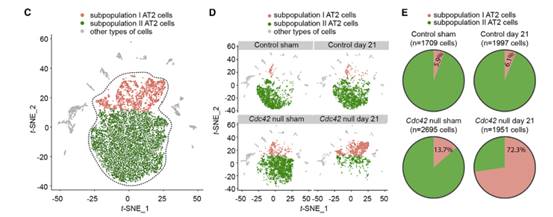
前面提到Cdc42空白小鼠的纤维化过程与IPF的特征性进展相似,作者使用IPF患者AT2细胞和亚群I AT2细胞进行对比分析,结果表明PNX处理的Cdc42空白肺中(1)亚群I AT2细胞的比例显著增加,(2)亚群I AT2细胞表现为活化的细胞骨架重塑和局灶性粘附,与IPF患者肺中的AT2细胞相似。
Result 4降低肺泡上皮的机械张力减轻肺纤维化的进展
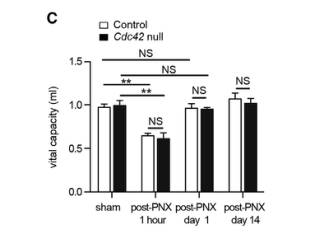
PNX处理对Cdc42空白小鼠肺纤维化有明显的促进作用,并增加纤维化肺中AT2细胞骨架重塑,表明肺纤维化与机械张力诱导的肺泡再生之间存在密切相关。首先作者通过原子力显微镜(AFM)观察发现Cdc42空白肺只有出现纤维化肺组织后,其组织刚度才会显著增加。然后测量了对照组和Cdc42空白小鼠的肺活量,PNX处理后对照组和Cdc42空白小鼠肺活量立即显著下降,但肺活量很快恢复到接近PNX处理前的水平,Cdc42空白小鼠通过升高肺泡压的方式恢复肺活量(图C)。
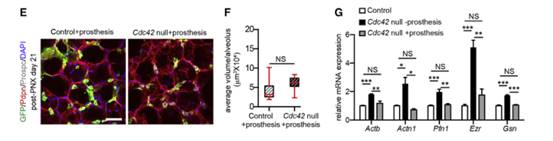
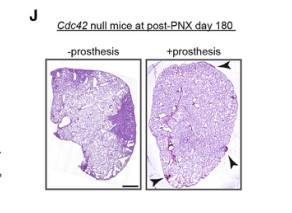
作者在PNX处理后第14天将假体植入对照组和Cdc42空白小鼠体内,此时一些Cdc42空白小鼠开始出现肺纤维化症状。研究发现假体植入后扩大的肺泡表型被大大挽救;抑制肌动蛋白细胞骨架调节基因的增加表达(图E-G);大大挽救了Cdc42空白肺中AT2细胞中基因表达的减少;H&E染色显示,在PNX后180天,植入假体的Cdc42空白小鼠的肺纤维化很小(图J)。由此可以得出结论,Cdc42空白肺肺泡上皮的机械张力增加是导致基因表达异常的原因,进一步证明了机械张力在Cdc42空白小鼠肺纤维化发展中的重要调节作用。
Result 5机械张力升高激活AT2细胞TGF-β信号回路
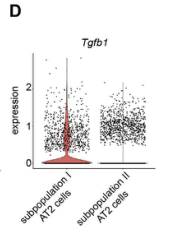
作者接下来进一步研究机械张力介导的肺纤维化的信号传导途径。此前结果表明TGF-β1的表达在亚群I AT2细胞中显著上调(图D和F),基于此基础,作者对培养的AT2细胞进行静态拉伸,证明对AT2细胞施加机械张力可以增加AT2细胞中TGF-β1的表达(图A和B)。使用ELISA试剂盒测量了小鼠AT2细胞中TGF-β配体的水平,在拉伸的AT2细胞的细胞裂解物和肺组织的裂解物中都检测到TGF-β配体的存在(图C)。
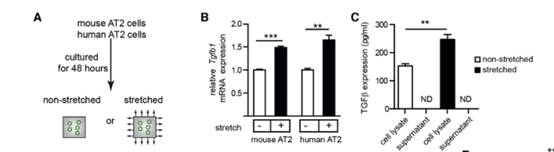
TGF-β在IPF进程中发挥着重要的作用,作者为了探究机械张力诱导的TGF-β在AT2细胞中的作用。我们用p-SMAD2抗体进行了免疫染色实验(图D-G)。结果显示在施加机械张力后,对照组AT2细胞和Cdc42空白肺中AT2细胞中的TGF-β信号均被激活。
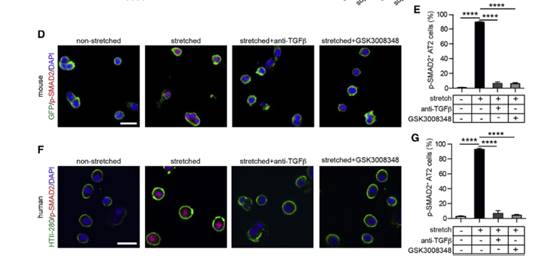
Result 6机械张力升高以空间调节的方式激活AT2细胞中的TGF-β信号
因为纤维化的迹象首先出现在肺部周围,作者进一步研究了机械张力是否以空间方式调节肺中TGF-β信号的激活,将多聚甲醛(PFA)缓冲液充气至不同压力的肺中观察AT2细胞的空间分布(图A)。结果显示(1)肺泡压力增加会增大肺泡的大小,(2)机械张力的影响在整个肺泡上皮中分布不均匀,位于周围区域的肺泡张开程度更大。
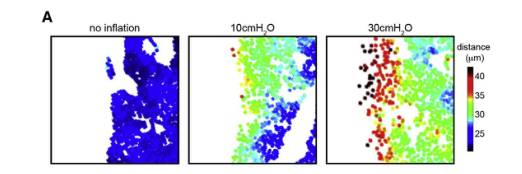
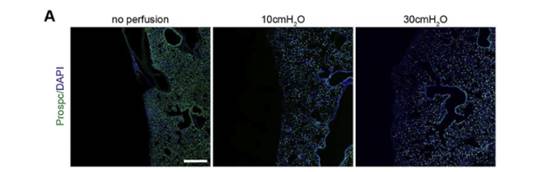
接下来作者在30cmH2O压力通风的小鼠的AT2细胞中检测到强核p-SMAD2信号,大多数表达p-SMAD2信号的AT2细胞位于肺周附近,免疫染色实验表明这些p-SMAD2+细胞是PDGFRa+成纤维细胞,而不是AT1细胞。这些结果都支持对肺泡上皮施加机械张力以空间方式激活AT2细胞TGF-β信号的假设。图(B-F)
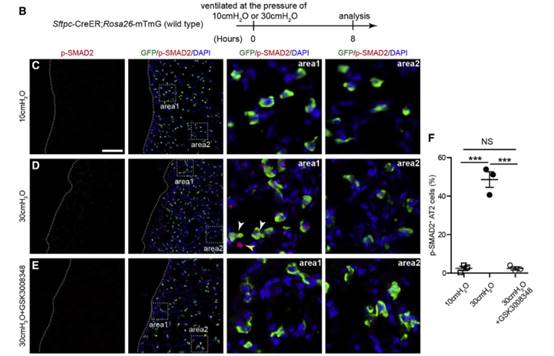
通过进一步对植入假体和未植入假体的对照组以及Cdc42空白小鼠肺中TGF-β信号的活性的评估,发现假体植入显著降低了Cdc42空白小鼠AT2细胞中TGF-β1的表达。(图G-J)
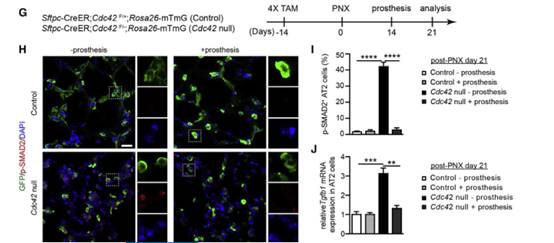
Result 7 AT2细胞中由机械张力激活的TGF-β信号对纤维化进展至关重要
以上结果证明肺泡上皮的机械张力升高以空间调节的方式激活AT2细胞中的TGF-β信号传导。作者用反面论证的方式,通过气管将表达TGF-β1的shRNA或AAV2 / 9病毒通过气管送入PNX处理的Cdc42空白小鼠的肺部,表达TGF-β1的shRNA处理后,AT2细胞中TGF-β1的表达水平以及基质细胞中Col1a1和Col1a2的表达水平显着降低(图D和E),表明AT2细胞中的TGF-β在肺纤维化中起关键作用进展。
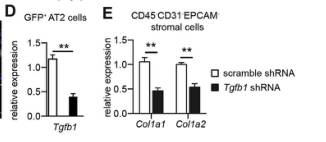
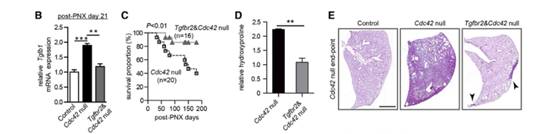
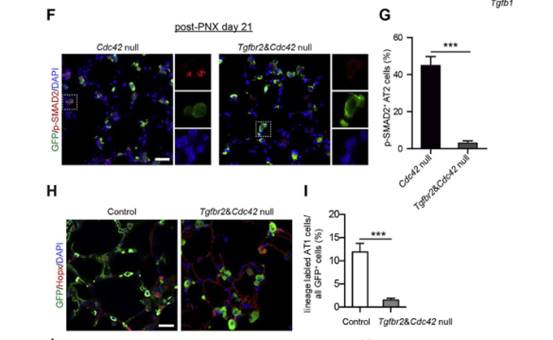
TGF-β配体与TGFBR2的结合对于激活TGF-β信号至关重要,作者生产了Sftpc-CreER;Tgfbr2F/F;Cdc42F/-;Rosa26-mTmG (Tgfbr2&Cdc42为空)的小鼠,这些小鼠的AT2细胞中不再有核p-SMAD2表达(图A、F和G)。与Cdc42空白小鼠的AT2细胞相比,Tgfbr2和Cdc42空白小鼠的AT2细胞中Tgfb1的表达水平显著降低(图B)。然而,在Cdc42空白小鼠肺中观察到的AT2细胞分化受损在这些双空小鼠肺中没有得到改善(图H和I),存活的比例也没有显著提高(图C),大多数Tgfbr2和Cdc42空白小鼠由于严重的肺纤维化而死亡(图D和E)。这些结果都表明AT2细胞中活化的TGF-β信号对机械张力驱动的肺纤维化的进展至关重要。
总结与讨论
在该项研究中,作者发现细胞周期调控蛋白Cdc42对肺泡干细胞的分化和再生起着关键的调控作用。Cdc42肺泡干细胞缺失(Cdc42 null)的小鼠在肺损伤(本文中采用的是小鼠左肺切除损伤模型)之后,不仅无法进行肺部再生,还发生了从肺叶边缘到中心不断进展的异常纤维化样改变。经过进一步的对比,研究组发现小鼠身上这样的病理改变从发病模式和发病特征等多个方面高度模拟了人的特发性肺纤维化(IPF)病变。
接下来,研究组通过一系列生物学实验手段发现:在肺损伤之后,肺泡区域由于肺泡的缺失,会经历短暂的异常升高的机械张力。机械张力会进一步诱导肺泡干细胞启动分化程序,去建立新的肺泡。随着新的肺泡的建立,升高的机械张力恢复到了生理水平。但是,Cdc42 null的小鼠遭受了肺损伤后,由于肺泡干细胞无法分化,新的肺泡未被建立。那么,肺泡区域就一直承受异常升高的机械张力。机械张力进一步激活肺泡干细胞中的TGF-β信号环路,从而引起肺泡干细胞周围的间质细胞异常增多和纤维化病变
该研究通过多基因敲除小鼠、单细胞测序、假体植入、数学模型和新的图像分析方法、对比已发表IPF数据库,用人组织样品验证假设等一系列生物学手段,系统地阐述了细胞周期调控蛋白Cdc42对AT2细胞的分化和再生起着关键的调控作用,并建立了肺泡再生受损、机械张力和进行性肺纤维化之间的直接机制联系,为特发性肺纤维化疾病的理解和治疗带来新的突破。
本文由2019级微生物与生化药学硕士研究生徐梦真供稿。