甲型流感病毒(IAV)是最常见的呼吸道病原体之一,每年在全世界造成至少50万人死亡。在过去的几十年里,疫苗和抗病毒药物在控制和治疗IAV感染方面取得了巨大的成功;然而,季节性IAV仍然存在。因此,迫切需要新的抗病毒策略,包括不同的病毒靶点、细胞靶点或免疫调节药物。2022年2月18日,中国农业大学刘金华教授、孙怡朋教授、代重山副教授团队在国际权威学术期刊《PLOS PATHOGENS》发表了题为“p21 restricts influenza A virus by perturbing the viral polymerase complex and upregulating type I interferon signaling”的文章首次揭示了p21通过干扰病毒聚合酶复合物和阻断HO-1降解促进IRF3激活增强I型干扰素表达抑制A型流感病毒复制的机制,阐明了宿主蛋白p21限制IAV的一种新的抗病毒疗法。

研究结果
1 基于细胞转录谱的 RNAi 文库筛选调节 IAV 感染的宿主因子
为了确定参与IAV复制的宿主因素,作者团队利用H5N1病毒感染A549细胞18h,提取总RNA,进行RNA-Seq分析。结果表明,314个基因在IAV感染的A549细胞中有显著差异表达,其中252个基因表达上调,62个基因表达下调。进一步利用针对先前未定义的前60个上调基因的文库在A549细胞中进行siRNA筛选。筛选结果显示6个宿主因子(ARRDC4、CDKN1A[p21Waf1/Cip1]、TYMP、PNPT1、TAP2和CHD2)是潜在的正调控因子,而1个宿主因子(FST)是IAV复制的负调控因子。其中p21基因敲除显著上调AH1病毒感染的A549细胞中NP mRNA的表达。此外,为研究p21基因在体内感染流感后的表达情况,用AH1病毒滴鼻感染C57BL/6J小鼠。各项结果显示小鼠肺组织中p21蛋白的表达上调,上调主要发生在作为IAV最初感染靶细胞的支气管壁和肺泡壁细胞中。证明了AH1病毒感染显著上调了p21蛋白在多个细胞系和小鼠动物模型中的表达。
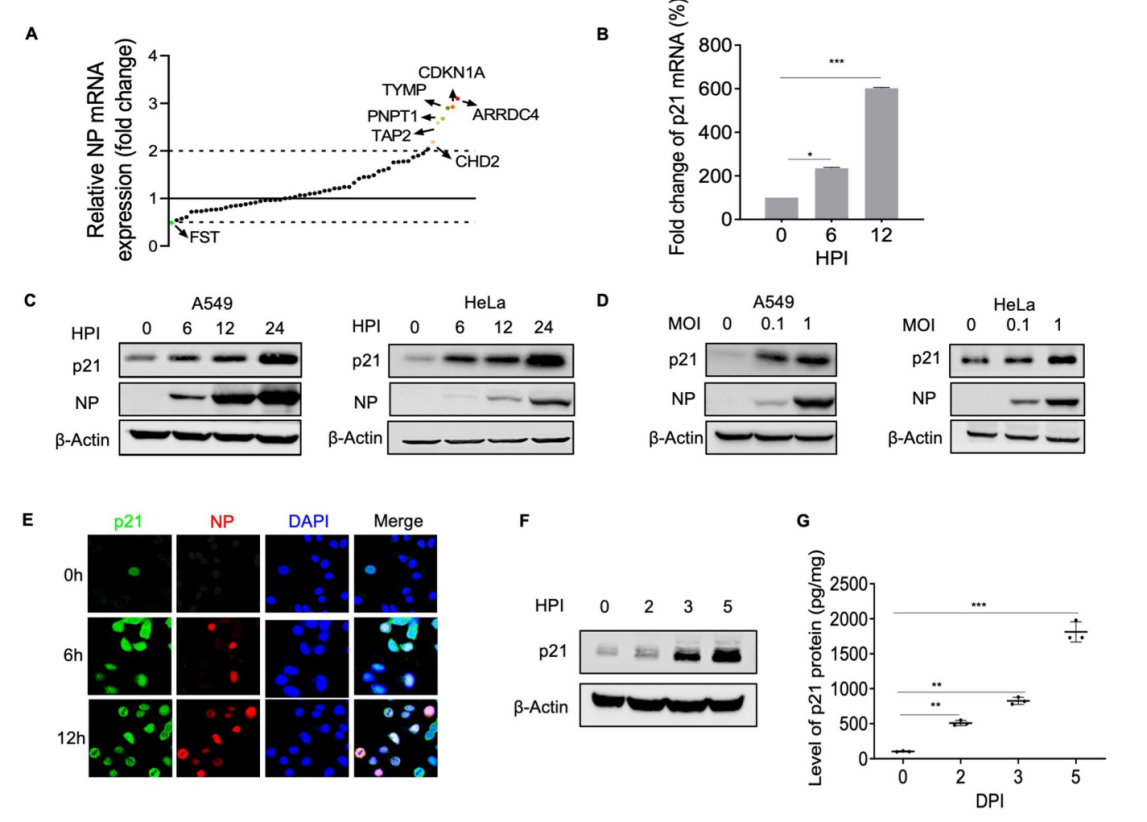
图1通过基于细胞转录图谱的siRNA筛选,确定调节IAV感染的宿主因子
2 p21 在体外和体内抑制 IAV 复制
作者团队初步观察做出假设,即p21可能影响流感病毒的复制。结果证明,用p21siRNA#1处理感染AH1病毒的A549细胞显著增加病毒的NP水平。敲除p21的HeLa细胞,与天然的HeLa细胞相比,AH1病毒的NP水平和滴度显著增加。同样,沉默p21蛋白也增加了AH1感染后NHBE细胞中NP的表达和病毒滴度。然后,采用一种特定的p21蛋白抑制剂UC2288的药理学方法来证实p21对IAV的抑制作用。证明UC2288(5μM)可显著提高AH1病毒感染后A549细胞的NP水平和病毒滴度。为进一步证实p21对病毒复制的抑制作用,将Flag-p21载体导入A549细胞,用AH1病毒感染A549细胞,并对H7N9、H3N2和H1N1进行评估。结果表明,p21在体外可以抑制不同亚型(包括H5N1、H7N9、H3N2和H1N1)的IAV的复制。

图2 体外和体内抑制IAV复制需要p21
3 p21 在与 IAV 的 PA 蛋白相互作用后上调
为了研究p21抑制IAV复制的机制,作者团队首先确定了p21与病毒蛋白之间的相互作用,且这些蛋白对病毒在感染细胞中的复制是有效的。作者团队将Flag标记的p21和HA标记的病毒蛋白(即PB2、PB1、PA、NP、M1和NS1)单独或联合导入HEK293T细胞。结果表明,在HEK293T细胞中,p21与流感病毒PA特异结合,但不与其他病毒蛋白(PB1、PB2、NP、M1和NS1)相互作用。 GST标记的p21和HA标记的PA蛋白的下拉试验证明了p21蛋白在体外可以与PA结合。表明,PA是IAV感染过程中p21的主要结合对象。免疫共沉淀结果显示PA-CBD与p21有很强的结合,而PA的N端与p21的相互作用很弱。这些结果表明,PA通过C端区域与p21结合。

图3 p21 在与 IAV 的 PA 蛋白相互作用后上调
4 p21 通过与 PB1 竞争 PA 结合来抑制 IAV 聚合酶活性
作者团队在研究中发现p21与PA的C-末端结构域相互作用。因此,推测p21可能与Pb1竞争PA结合以限制IAV的RdRp活性。作者团队将p21或siP21双链基因导入HEK293T细胞,然后与PA、PB1、PB2、NP、pPolI-NS-firefly和pCMV-RL共转染。在48h后,进行双荧光素酶检测。结果表明,p21基因敲除使RNP活性显著增加至~2.5倍,而p21过表达显著降低RNP活性至~3倍。此外,作者团队还将FLAG标记的p21、PA、PB1和PB2质粒转入p21-KO HEK293T细胞。发现p21以剂量依赖的方式与PB1竞争PA结合并降低聚合酶复合体中的PB1蛋白,而PB1-PB2相互作用保持不变。这一发现表明,p21通过竞争PA C-末端的PB1结合基序,减少了PB1与RdRp复合体的掺入,从而破坏功能性IAV聚合酶复合体的形成。
5 p21 在IAV感染后正向调节I型IFN表达
IAV感染可以诱导细胞因子的表达,以启动固有的宿主防御。为明确p21蛋白在IAV感染宿主防御中的作用,作者团队将针对p21蛋白的特异性siRNA或干扰siRNA导入A549细胞,进行RNA-Seq检测。KEGG通路分析(截断P值< 0.01和|log2(倍数变化)|>1)发现,p21的沉默显著改变了各种通路,其中流感A通路受到的影响最大。qPCR结果显示,在p21-KO细胞中,6hpI和12hpI时干扰素-β基因的丰度显著降低。AH1病毒感染的p21-KO细胞中干扰素-β的表达水平显著降低。此外,评估AH1病毒感染后WT和p21-KO HEK293T细胞中p-IRF3的水平。结果表明,与p21-WT HEK293T细胞相比,AH1病毒诱导的p-IRF3在p21-KO HEK293T细胞中的表达上调被完全抑制。AH1病毒感染p21-KO A549细胞后,ISG-15、OAS1和Mx1的表达显著降低。这些结果表明,p21缺失抑制了IRF3核的激活,从而抑制了小鼠干扰素的产生。

图5 p21正向调节IAV感染时I型干扰素的表达
6 p21 通过与 HO-1 相互作用促进 IRF3 的激活
为了确定p21是如何调节IRF3磷酸化的,在IAV感染后用亲和纯化结合质谱分析的方法检测p21蛋白复合体。发现HO-1在筛选列表中排在前三位。然后通过免疫共沉淀法鉴定了p21和HO-1在A549细胞中的相互作用。为研究这种相互作用的功能意义,将p21表达质粒转染到p21KO中,检测HO-1的蛋白水平。数据显示,p21的表达以剂量依赖的方式增加HO-1蛋白的水平。为确定 HO-1是否参与IAV感染后p21对IRF3激活的调控,将HO-1表达载体导入 p21-KO HEK293T细胞,检测病毒感染后不同时间点IRF3的激活水平。结果表明,p21缺失抑制了AH1病毒对IRF3磷酸化的诱导,但这种抑制作用在HO-1蛋白的存在下被挽救。
为确定HO-1激活是否能挽救p21缺乏所致的病毒复制增加,作者团队给 p21−/−小鼠灌胃HO-1诱导剂氯化血红素(5 mg/kg),并测定肺病毒滴度。与p21−/−小鼠相比,氯化血红素治疗可上调肺组织HO-1蛋白表达,显著降低肺组织NP蛋白表达和病毒滴度。这些结果提供了确凿的证据,表明p21−/−小鼠更容易受到IAV的感染,而HO-1的激活可以挽救由于p21缺乏而导致的病毒复制增加。
7 p21 肽模拟物抑制 IAV 复制
为确定p21蛋白在抗IAV作用中起关键作用的功能区域,构建一系列截短的p21构建体,并将其融合到GFP-Tag的N端,然后将它们接种到感染AH1病毒的A549细胞。结果表明,p21蛋白第36-43位氨基酸序列具有抗IAV活性。为进一步证实该氨基酸序列的功能,合成p21多肽模拟物(36-43),并在A549细胞中检测它们对IAV复制的影响。结果表明,这些肽以剂量依赖性的方式抑制NP的表达,在模拟肽处理的A549细胞中,病毒滴度显著降低。然后,测试多肽模拟物对IAV聚合酶和干扰素途径的影响,发现它们可以抑制IAV聚合酶的活性。在病毒感染后,p21多肽模拟物处理也显著增加HO-1蛋白的表达,进而促进干扰素-β的转录活性。
为进一步评价p21多肽模拟物在体内对IAV的保护作用,小鼠每隔48h给予一次多肽模拟物(15 mg/kg)。与模拟多肽小鼠相比,小鼠体重显著减轻,在3dpi和5dpi时,小鼠肺组织中的病毒滴度显著高于多肽模拟小鼠。此外,模拟多肽处理的小鼠肺组织中NP蛋白的表达水平显著降低。

图7 p21多肽模拟抑制IAV复制
该研究团队基于长期积累的动物流感病毒研究基础,结合全基因组RNAi文库筛选,以及体外和体内病毒研究模型,首次揭示了p21的抗流感病毒机制。研究结果表明,p21通过干扰病毒聚合酶复合物和阻断HO-1降解促进IRF3激活上调I型干扰素信号转导抑制A型流感病毒复制,并筛选鉴定了p21的一个8氨基酸肽作为有效抑制IAV复制的最小基序。为新型抗流感药物的开发提供了理论依据,对重要人畜共患病的防控具有重要参考价值。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35180274/